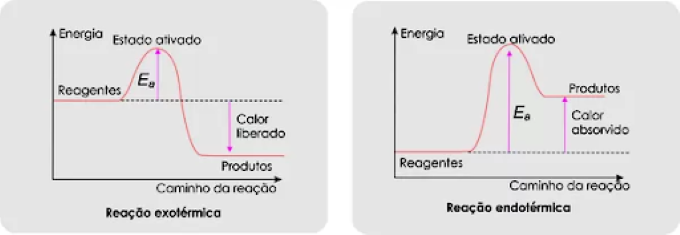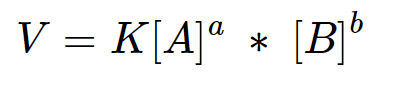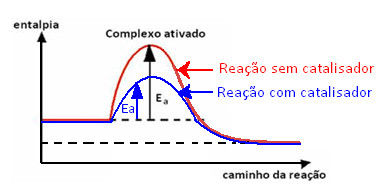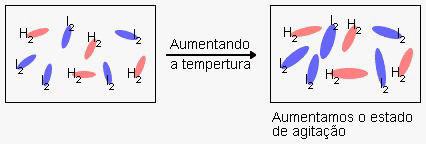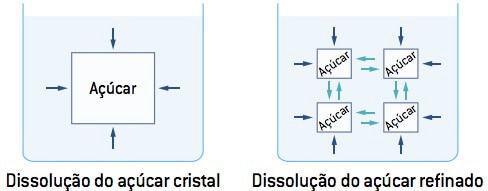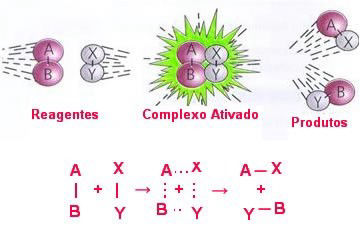
Nos gráficos mostrados ao lado, a energia de ativação é igual ao valor da energia do complexo ativado (estado ativado) menos o valor da energia dos reagentes, onde o complexo ativado é o pico mais alto de energia.
Energia de ativação = Hcomplexo ativado − Hreagentes