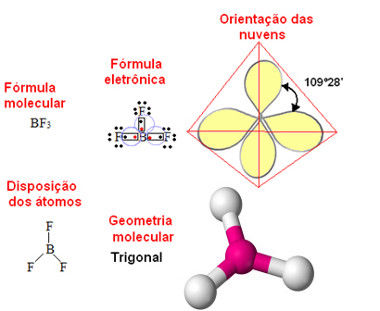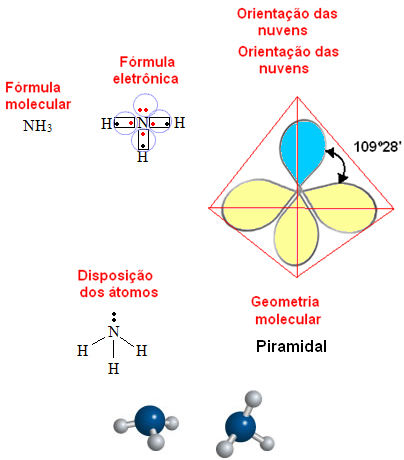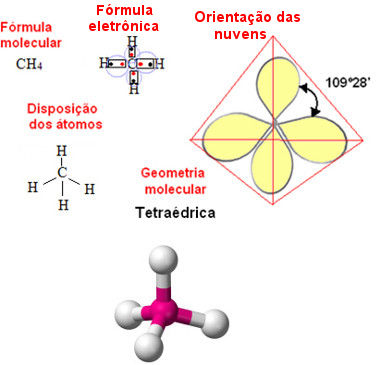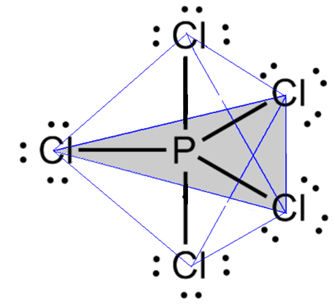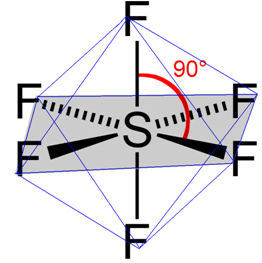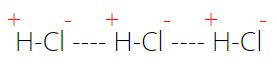
Forças de dipolo-permanente
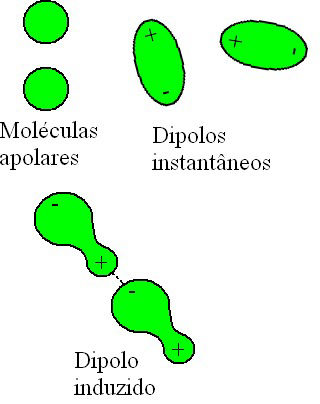
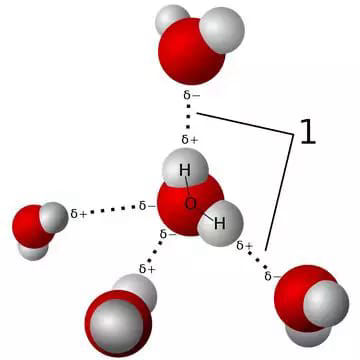
A interação dipolo-permanente, ou dipolo-dipolo, acontece entre moléculas que são polares, ou seja, que possuem dois polos: um positivo e um negativo. Ela pode acontecer entre moléculas de uma mesma substância ou entre moléculas de substâncias distintas.
Esta força intermolecular é uma interação de força intermediária, que acontece por meio da formação de um dipolo elétrico quando um polo positivo atrai e se liga a um polo negativo.