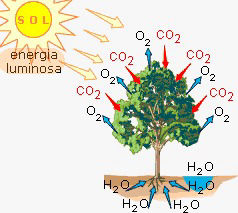
Reações endotérmicas
Endo significa para dentro, portanto as reações endotérmicas são aquelas nas quais há absorção de calor. Por absorver o calor do meio em que está inserida, a reação endotérmica provoca uma sensação de resfriamento.
Exemplos: ebulição da água, fusão da água e fotossíntese.
