Exemplo e a reação nos eletrodos:
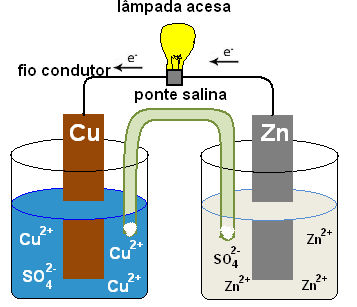
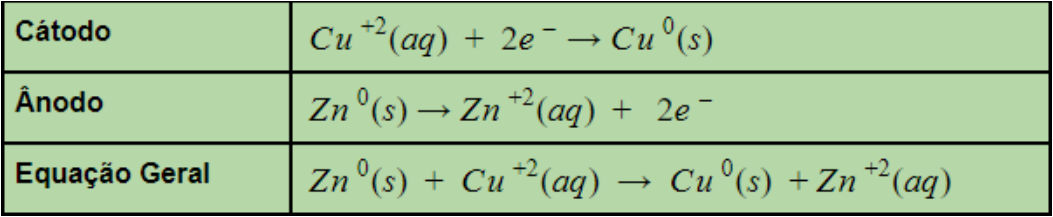
A eletroquímica estuda a relação da produção de corrente elétrica e de reações químicas que ocorrem com transferência de elétrons. A eletroquímica pode ser dividida em dois ramos: estudo de pilhas e bateria e o estudo da eletrólise.
Pilhas e baterias
As pilhas eletroquímicas, também chamadas de células eletroquímicas, se trata de um sistema onde acontece a reação de oxirredução, se houver duas ou mais pilhas conectadas forma-se uma bateria. Essas pilhas podem ser definidas como: “Dispositivos capazes de transformar energia química em energia elétrica por meio de reações espontâneas de oxirredução (onde há transferência de elétrons).”
Nas pilhas existem dois componentes importantes, que são dois eletrodos, que é a superfície sólida que possibilita a troca de elétrons.
Ânodo: eletrodo onde ocorre oxidação, representando o polo negativo.
Cátodo: eletrodo onde ocorre a redução, representando o polo positivo.
Eletrólito/Ponte salina: serve para manter as semicelas(onde os eletrodos estão) neutras.
Fio condutor: é por onde os elétrons são conduzidos do ânodo para o cátodo.

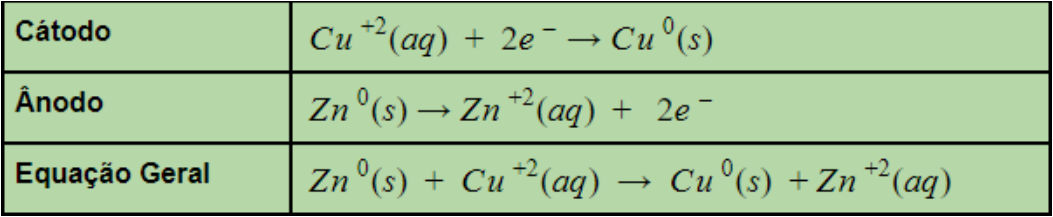
A diferença de potencial é o número que representa a tendência de perder ou ganhar elétrons de uma substância. No potencial padrão de redução é analisada a tendência a ganhar elétrons. No potencial padrão de oxidação é analisada a tendência a perder elétrons.
A diferença de potencial é obtida subtraindo os potenciais dos elementos da reação.
ΔE° = E°maior − E°menor
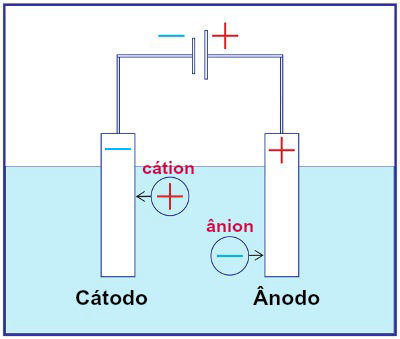
A eletrólise é um processo físico-químico onde é produzido energia química por meio da reação de oxirredução, essa reação é provocada por uma corrente elétrica, e por isso a reação de oxirredução na eletrólise não é espontânea. Na eletrólise a um gerador com corrente contínua, onde o ânodo é o polo positivo que atrai os ânions, que são oxidados, enquanto o cátodo é o polo negativo que atrai os cátions, e esses cátions sofrem redução.
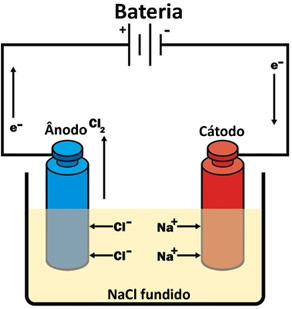
Reação nos eletrodos:
Cátodo: 2 Na+ (l) + 2e- → 2Na(s) (2x)
Ânodo: 2 Cl- (l) → 2 e- + 1 Cl2(g)
Reação Global: Na+ (l) + 2 Cl- (l) → Na(s) + 1 Cl2(g)
A eletrólise ígnea utiliza compostos iônicos fundidos, ou seja, estes compostos são aquecidos em alta temperatura até chegar ao estado líquido. O composto iônico fundido será colocado em uma cuba eletrolítica, em que possui dois eletrodos submersos ligados a uma fonte geradora de corrente elétrica.
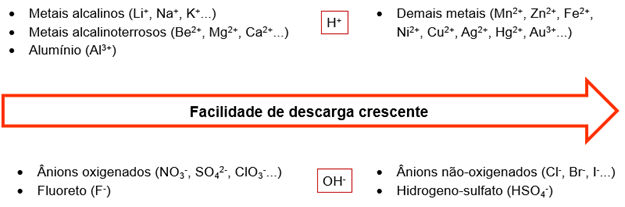
PRIORIDADE DE DESCARGA
Na eletrólise aquosa vai ser utilizado uma solução de íons dissolvidos em água, essa solução aquosa deve ser ácidos, bases ou sais. É preciso considerar a autoionização da água, onde são produzidos os íons H+ e OH-.
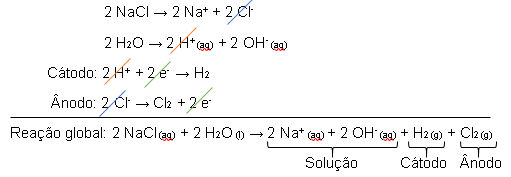

A corrosão dos metais é um processo eletroquímico que acontece espontaneamente, e está presente em nosso cotidiano, e é causada pela reação de oxirredução, entre o metal e os agentes naturais, como o gás oxigênio. Esse processo ocasiona muitos prejuízos econômicos. Para combater essa corrosão é utilizado os metais de sacrifício, ou uma proteção mecânica que serve como revestimento, além de outros tipos de proteção.

Na tabela acima, é perceptível por meio do potencial de oxidação que o magnésio possui uma tendência a oxidar maior que a do ferro, por isso o metal de magnésio pode ser usado como metal de sacrifício para proteger o ferro da corrosão.
O metal de sacrifício é uma técnica de proteção que também pode ser denominada como galvanoplastia. Para conseguir proteger o ferro da corrosão é utilizado um metal que tenha uma tendência maior que a do ferro de oxidar, normalmente utiliza-se o magnésio para essa finalidade, ele se oxida e impede a oxidação do ferro, por isso é chamado de metal de sacrifício. Se o metal de sacrifício utilizado for o zinco o processo será chamado de galvanização.
Mobirise site builder - Learn more