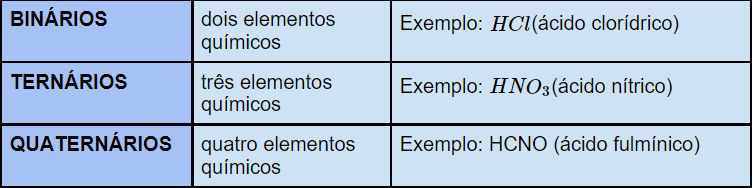
Eles também podem ser classificados de acordo com o número de elementos químicos, como mostra a tabela.
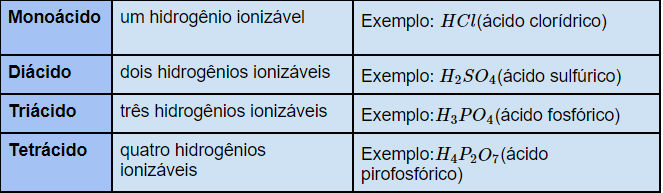
Os ácidos também podem ser classificados segundo a quantidade de hidrogênios ionizáveis, como mostra na tabela.
As funções inorgânicas representam os grupos que não possuem carbono como elemento químico central, e é subdividido em quatro grupos: ácidos, bases, sais e óxidos.
Os ácidos são compostos covalentes, que segundo a teoria de Arrhenius ionizam e formam cargas em água, liberando o H3O + (hidrônio) como único cátion, que também pode ser representado de forma mais simplificada como H +. Os compostos ácidos possuem algumas características, dentre elas estão:
- Incolor;
- Odor forte ;
- PH inferior a 7;
- Estado físico: líquido;
- Apenas os ácidos mais fortes têm poder corrosivo, para ele ser forte ele deve ter alfa maior ou igual à 50%;
- Conduzem eletricidade em solução aquosa.
Os ácidos podem ser classificados quanto à presença ou a falta de oxigênio. Se o composto ácido não possuir oxigênio será chamado de hidrácido, que é volátil, ou seja, seu ponto de ebulição é menor que 100°C, o HCl (ácido clorídrico), e o HBr (ácido bromídrico) são exemplos de hidrácidos. Se o composto ácido tiver à presença de oxigênio ele será chamado de oxiácido, seu ponto de ebulição será maior que 100ºC, exceto o HNO3 (ácido nítrico), que é volátil como os hidrácidos, um exemplo de oxiácido é o H2SO4 (ácido sulfúrico).

Eles também podem ser classificados de acordo com o número de elementos químicos, como mostra a tabela.

Os ácidos também podem ser classificados segundo a quantidade de hidrogênios ionizáveis, como mostra na tabela.

Podemos determinar o grau com que os ácidos são ionizados em água, para isso é determinada a força ácida que pode ser obtida de mais de uma forma, a fórmula para calcular a força ácido é
a = nº de moléculas ionizadas / nº de moléculas dissolvidas
a = nº de moléculas ionizadas / nº de moléculas dissolvidas, a classificação da força ácida é dada pelo grau de ionização.
A força ácida nos oxiácidos pode ser determinada de maneira diferente, basta fazer o número de oxigênios menos o número de hidrogênios para saber o grau de ionização, o ácido será muito forte se o valor for igual a 3, se for igual a 2 será forte, será moderado se for igual a 1 e terá força ácida fraco caso o valor seja igual a 0.
a = nº de oxigênios − nº de hidrogênios
a = nº de oxigênios − nº de hidrogênios
O H2CO3 (ácido carbônico) é uma exceção, pois é um ácido instável. Se usarmos a fórmula da força ácida nos oxiácidos, teríamos que o ácido carbônico possui força moderada, contudo, o ácido carbônico por ser um ácido instável, é um ácido do tipo fraco, já que antes de ionizar liberando H+, ele se torna em H2O e CO2, liberando apenas uma pequena quantidade de H+.
Nos hidrácidos a força ácida leva em consideração o tamanho do átomo, por isso quanto maior o tamanho do átomo, maior a sua força ácida.
● Ácidos fortes → HI, HBr, HCl
● Ácidos moderados → HF
● Ácidos fracos → H2S, HCN
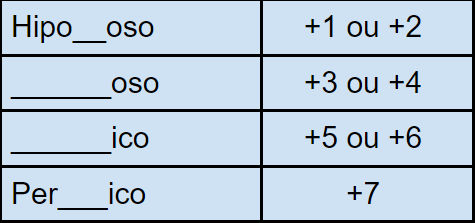
A nomenclatura dos oxiácidos pode ser definida de acordo com o NOX do ácido, sendo que o nox do hidrogênio equivale a 1 e o do oxigênio a -2.
Exemplo: H2SO4 → ácido sulfúrico
2 + X + (-2*4) = 0
2 + X - 8 = 0
X = 8 - 2
X = 6 → NOX de S
Exceções:
● H2CO3 → ácido carbônico, e não ácido carbonoso.
● H3BO3 → ácido bórico, e não ácido boroso.
As bases são substâncias inorgânicas que sofrem dissociação iônica quando colocadas em água, onde ocorre a liberação de íons: cátions e do ânion OH-. Os compostos básicos também podem ser chamados de alcalinos. As características das bases são:
● Compostos iônicos.
● Conduz corrente elétrica em solução aquosa.
● pH maior do que 7.
● Formada por um cátion metálico ligado a hidroxila (OH-), com exceção do hidróxido de amônia (NH4OH).
● Sabor adstringente.
● Reagem com ácidos.
● Possuem maior ponto de fusão se comparado com os ácidos.
● São receptoras de prótons
Exemplos de dissociação:
● 1 NaOH + H2O → 1 Na1+ + 1 OH1-
● 1 Al(OH)3 + H2O → 1 Al3+ + 3 OH1-
Podemos encontrar algumas bases em nosso cotidiano, como o sabão, utilizado para limpeza no dia a dia, já que é produzido por meio da reação do hidróxido de sódio (NaOH) com gorduras e óleos, o hidróxido de sódio também é conhecido como soda cáustica, e é utilizado na remoção de sujeira pesada, e na produção de tecido, papel e produtos de uso doméstico. Temos também o leite de magnésia, constituído de hidróxido de magnésio (Mg(OH)2), que é usado para combater a acidez estomacal. Temos a amônia, que é utilizada na produção de fertilizantes.
A solubilidade das bases, é algo variável, e depende do elemento formador. Quanto mais solúvel for a base, maior será a quantidade de cátions e ânions liberados.
a) Base solúvel → elementos da família 1A (metais alcalinos) ligados a OH, e também o hidróxido de amônia.
b) Base parcialmente solúvel → elementos da família 2A (metais alcalinos terrosos) ligados a OH.
c) Base praticamente insolúvel → os elementos metálicos que não pertencem nem à família 1A e nem à família 2A que são ligados a OH.
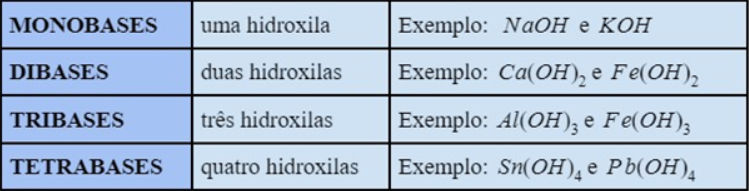
As bases podem ser classificadas segundo o número de hidroxilas, como mostra a tabela.
A força das bases é determinada pela família ou grupo que o elemento se encontra:
● FORTE → Família 1A e 2A, exceto o Be e o Mg.
● FRACA → Be e Mg, e os demais metais, e NH4OH.
A nomenclatura das bases é formada pelo “hidróxido + nome do metal”.
Exemplos:
● NaOH → Hidróxido de sódio
● KOH → Hidróxido de Potássio
● Al(OH)3 → Hidróxido de alumínio.
A nomenclatura para os metais que possuem nox variável muda, a nomenclatura passa a ser formada por “hidróxido + nome do metal + carga do metal”, ou também avaliando a carga máxima e a carga mínima.
● ICO → carga máxima
● OSO → carga mínima
Exemplos:
● Fe(OH)2 → Hidróxido de Ferro II ou Hidróxido ferroso.
● Fe(OH)3 → Hidróxido de Ferro III ou Hidróxido férrico.
Os sais são compostos que em água se dissociam, liberando pelo menos um cátion diferente de H+, e pelo menos um ânion diferente de OH-. Os sais são formados a partir da reação entre um ácido e uma base, essa reação é chamada de neutralização, pois forma H2O. Dentre as características dos sais estão:
● Sólidos em temperatura ambiente;
● Possui elevado ponto de fusão e de ebulição;
● Formados a partir de ligações iônicas;
● Conduzem corrente elétrica no estado líquido;
● A maioria dos sais é solúvel em água.
Os sais são muito utilizados no cotidiano, como o cloreto de sódio (NaCl), usado no sal de cozinha, no soro fisiológico, temos também o carbonato de sódio (Na2CO3), utilizado na produção de vidro e de corantes, no tratamento de piscinas, na produção de sabão e detergente. Há também o bicarbonato de sódio (NaHCO3), utilizado como antiácido, fermento de bolo, em cremes dentais e extintor de incêndio, estes são alguns exemplos de sais usados no dia a dia.
A nomenclatura dos sais é formada pelo nome do ânion (derivado do ácido) + nome do cátion (derivado da base). A nomenclatura do ânion dos sais depende de que tipo de ácido é, se é um hidrácido ou se é um oxiácido.
Nos Hidrácidos → a nomenclatura é formada pelo radical do nome do elemento mais o sufixo “ídrico”, o ânion recebe a nomenclatura segundo o radical do nome do elemento mais o sufixo “eto”.
● ÍDRICO → ETO
Nos Oxiácidos → a nomenclatura do ânion dos oxiácidos pode ser definida de acordo com o NOX do ácido, sendo que o NOX do hidrogênio equivale a 1 e o do oxigênio a -2.
● OSO → ITO
● ICO → ATO
Os sais são obtidos por meio da reação de neutralização, que é a reação entre um ácido e uma base.
➔ Ácido + Base → Água + Sal
Exemplos de neutralização:
HNO3 + KOH → H2O + KNO3 (Nitrato de Potássio)
H2SO4 + Fe(OH)3 → H2O + Fe2(SO4)3
Reação balanceada:
3 H2SO4 + 2 Fe(OH)3 → 6 H2O + Fe2(SO4)3 (Sulfato de ferro III)
Pode ocorrer neutralização parcial, onde apresenta uma classificação diferente.
● HIDROGENOSSAIS OU SAIS ÁCIDOS → no sal resultante encontrasse um H. Exemplo: NaHCO3 (hidrogeno carbonato de sódio ou bicarbonato de sódio).
● HIDROXISSAIS OU SAIS BÁSICOS → No sal resultante encontrasse um OH. Exemplo Mg(OH)Cl (hidróxicloreto de magnésio)
● SAIS DUPLOS OU MISTOS → Sais formados por mais de um cátion ou ânion. Exemplo: NaKSO4 (sulfato de sódio e potássio).
● SAIS HIDRATOS → Sais que possuem água de cristalização. Exemplo: CuSO4.5H2O (sulfato de cobre pentahidratado).
Os óxidos são compostos oxigenados bivalentes, ou seja, são formados por dois elementos, onde o oxigênio é o elemento mais eletronegativo.
Os óxidos básicos reagem com água e formam bases, ou em água reagem com ácido formando sal e água. Podem ser chamados de óxidos iônicos. Eles são formados por um metal mais o oxigênio, podemos classificá-los pelo valor do NOX, se o NOX for menor ou igual a 3 então é um óxido básico.
Exemplos de reação:
● Na2O + H2O → 2 NaOH
● CaO + H2O → Ca(OH)2
● FeO + H2O → Fe(OH)2
A nomenclatura dos óxidos básicos depende do tipo de metal que está ligado ao oxigênio, se for um metal de carga fixa, o nome será dado por óxido + nome do elemento, exemplo: óxido de sódio (Na2O). Para os metais de carga variável, o nome será óxido + nome do elemento + carga, exemplo: óxido de ferro II (FeO).
Os óxidos ácidos reagem com água e formam ácidos, ou reagem com base formando sal e água. Podem ser chamados de óxidos moleculares. São formados pela ligação entre um ametal mais o oxigênio, podemos identificá-los pelo valor do NOX, se o NOX for maior ou igual a 4 então é um óxido ácido.
Exemplos de reação:
● SO3 + H2O → H2SO4
● SO2 + H2O → H2SO3
● CO2 + H2O → H2CO3
O nome dos óxidos ácidos é o prefixo que indique a quantidade de oxigênio, mais óxido, mais o prefixo que indique a quantidade de átomos do outro elemento.
Exemplos:
● CO2 → dióxido de carbono.
● N2O → monóxido de dinitrogênio.
● SO3 → trióxido de enxofre.
Existem outros tipos de óxidos, além dos óxidos básicos e óxidos ácidos, que são:
● ÓXIDOS ANFÓTEROS → Óxidos de duplo caráter, frente a uma base se comporta como um ácido, frente a um ácido se comporta como uma base.
● ÓXIDOS NEUTROS → Não reage com água, base ou ácido, podendo reagir com outros tipos de substâncias.
● PERÓXIDOS → Ao reagirem com água ou ácidos diluídos produz água oxigenada (H2O2).

Também há o gelo seco, que é um dióxido de carbono no estado sólido, no estado gasoso o dióxido de carbono é o principal responsável pelo efeito estufa.
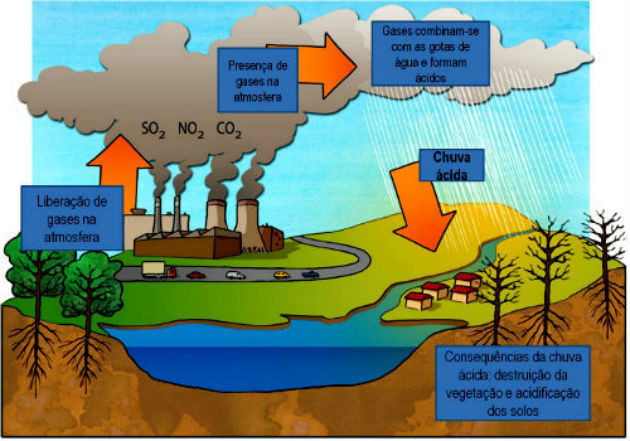
A chuva ácida é um exemplo de óxidos no cotidiano, ela é provocada pelos óxidos ácidos que vão para o ar e reagem com a água formando ácidos, as indústrias são as principais responsáveis por esse acontecimento, a imagem ilustra o que acontece.
Made with Mobirise